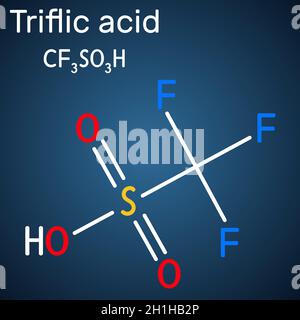
L'acido trifluorometansolfonico, noto anche con il nome comune di acido triflico, abbreviato come HOTf, è un acido solfonico di formula CF3SO3H. In condizioni normali è un liquido incolore di odore pungente, miscibile con l'acqua in tutte le proporzioni. È un acido molto forte, usato soprattutto nell'ambito della ricerca come catalizzatore e precursore in chimica organica.
Storia
L'acido triflico fu preparato per la prima volta nel 1954 da Haszeldine e Kidd tramite la procedura schematizzata nella figura seguente:
Sintesi
Industrialmente l'acido triflico si produce per fluorurazione elettrochimica (ECF) dell'acido metansolfonico:
Il CF3SO2F formato viene idrolizzato, e il sale triflato risultante viene protonato. In alternativa, l'acido triflico si ottiene per ossidazione di CF3SCl:
L'acido triflico è purificato per distillazione dall'anidride triflica.
Reattività
L'acido triflico in condizioni normali è un liquido incolore igroscopico, di odore pungente. Fuma all'aria e in presenza di umidità forma un monoidrato stabile, CF3SO3H·H2O, che ha un punto di fusione di 34 °C. Oltre che in acqua, l'acido triflico si scioglie in solventi polari come DMF, DMSO, acetonitrile e dimetilsolfone. L'aggiunta di acido triflico a solventi polari può essere pericolosamente esotermica.
L'acido triflico ha Ka = 8,0 × 1014 e di conseguenza è considerato un superacido. È un composto molto utile in virtù della sua elevata stabilità termica e chimica. Sia l'acido che la sua base coniugata CF3-SO3– (ione triflato, OTf–) sono molto resistenti a processi di ossidoriduzione, mentre altri acidi forti come HClO4 e HNO3 sono ossidanti. Un altro vantaggio dell'acido triflico è che non dà reazioni di solfonazione, come possono invece fare altri acidi forti come l'acido solforico stesso (H2SO4), l'acido fluorosolforico (F-SO3H) e l'acido clorosolforico (Cl-SO3H).
Usi
In laboratorio l'acido triflico è utile per reazioni di protonazione perché la sua base coniugata non è nucleofila. Viene utilizzato anche come titolante in titolazioni acido-base in ambienti non acquosi perché si comporta da acido forte in molti solventi (acetonitrile, acido acetico ecc.) dove i comuni acidi minerali come HCl e H2SO4 sono di forza moderata.
Formazione di sali
HOTf reagisce esotermicamente con carbonati e idrossidi dei metalli. Un esempio è la sintesi di Cu(OTf)2:
Leganti cloruro possono essere convertiti nei corrispondenti triflati:
Questa conversione è effettuata in acido triflico puro a 100 °C, facendo poi precipitare il sale per aggiunta di etere.
Reazioni organiche
L'acido triflico reagisce con alogenuri acilici per formare anidridi miste triflate, che sono forti agenti acilanti, ad esempio in reazioni di Friedel-Crafts.
L'acido triflico catalizza la reazione di composti aromatici con cloruri solfonilici R-S(=O)2-Cl; probabilmente un intermedio è l'anidride mista dell'acido solfonico.
L'acido triflico catalizza altre reazioni di tipo Friedel-Crafts, come il cracking di alcani e l'alchilazione di alcheni, reazioni molto importanti nell'industria petrolifera. Questi catalizzatori derivati dall'acido triflico sono molto efficienti per l'isomerizzazione di idrocarburi a catena lineare o leggermente ramificata, utile per aumentare il numero di ottano dei carburanti.
L'acido triflico reagisce esotermicamente con alcoli per formare eteri e olefine:
Indicazioni di sicurezza
L'acido trifluorometansolfonico è disponibile in commercio. È un liquido tossico per inalazione e nocivo per ingestione. Per contatto provoca gravi ustioni a pelle, mucose e occhi. Non ci sono dati che indichino proprietà cancerogene. È considerato poco pericoloso per le acque e gli organismi acquatici.
Note
Bibliografia
- N. E. Dixon, G. A. Lawrance, P. A. Lay, A. M. Sargeson e H. Taube, Trifluoromethanesulfonates and trifluoromethanesulfonato-O complexes, in Inorg. Synth., vol. 28, 1990, pp. 70-76, DOI:10.1002/9780470132593.ch16. URL consultato il 27 febbraio 2012.
- R. N. Haszeldine e J. M. Kidd, Perfluoroalkyl derivatives of sulphur. Part I. Trifluoromethanesulphonic acid, in J. Chem. Soc., 1954, pp. 4228-4232, DOI:10.1039/JR9540004228. URL consultato il 27 febbraio 2012.
- R. D. Howells e J. D. Mc Cown, Trifluoromethanesulfonic acid and derivatives, in Chem. Rev., vol. 77, n. 1, 1977, pp. 69-92, DOI:10.1021/cr60305a005. URL consultato il 27 febbraio 2012.
- G. Siegemund, W. Schwertfeger, A. Feiring, B. Smart, F. Behr, H. Vogel e B. McKusick, Fluorine Compounds, Organic, in Ullmann's Encyclopedia of Industrial Chemistry, John Wiley & Sons, 2007, DOI:10.1002/14356007.a11_349.
- L. R. Subramanian, A. G. Martínez, M. Hanack, G. K. S. Prakash e J. Hu, Trifluoromethanesulfonic Acid, in e-EROS Encyclopedia of Reagents for Organic Synthesis, John Wiley & Sons, 2006, DOI:10.1002/047084289X.rt246.pub2.
Altri progetti
- Wikimedia Commons contiene immagini o altri file su acido trifluorometansolfonico